두경부암 치료 중 나타나는 흡인의 원인
Cause of Aspiration During HNC Treatment
Article information
Trans Abstract
Aspiration, the entry of material into the airway below the true vocal folds, has been reported in various type of postsurgical head and neck patients. The important of correctly identifying the cause of aspiration in the head and neck surgical patient. Clearly each cause represents a different physiologic or anatomic disorder which requires different management strategy. We discuss about the cause of aspiration during head and neck treatment.
서 론
연하는 상부 소화호흡기를 지배하는 여러 신경과 근육들의 조화로운 조절에 의해 구강으로부터 인두를 거쳐 식도로 진행시키는 일련의 생리적 과정으로 제5, 7, 9, 10, 12번 뇌신경이 관여한다. 이러한 정상 연하기능에 장애가 발생하는 경우 침이나 섭취한 액상 또는 고형의 식괴 및 위 역류 물질이 성문 아래에 위치하는 기도로 유입되는 흡인이 발생하게 된다. 소량의 흡인은 정상인에서도 발생할 수 있으나 대부분의 경우 흡인 방어 체제에 의해 합병증 없이 제거되나, 만성 흡인이 있는 경우 음식물 섭취에 제한이 될 뿐만 아니라 폐기관지 합병증을 유발하고 심한 경우 폐혈증에 이르러 사망을 초래할 수도 있다. 이러한 만성 흡인의 원인은 다양하며 중추 및 말초 신경계 이상, 외상, 감염, 선천적 및 후천적 구조 이상 등으로 발생할 수 있다[1]. 대부분 노인과 쇠약한 환자에서 흔하나, 한편으로는 두경부암 환자에서 치료와 관련되어 발생하는 흔한 후유증의 하나이기도 하다[2,3]. 따라서 흡인은 두경부암 환자의 안전 및 삶의 질 향상과 밀접하게 관련되어 있으며 이들을 치료하는 의사는 흡인의 발생 원인을 알고 적절하게 진단하고 치료하는 것이 필수적이라 할 수 있다[4].
본 종설을 통해 두경부암 환자에서 치료와 관련되어 발생하는 흡인의 원인에 대한 문헌 고찰을 통하여 흡인에 대처할 때 고려해야 할 점들을 논해보고자 한다.
본 론
1. 연하 및 흡인과 관련된 구조
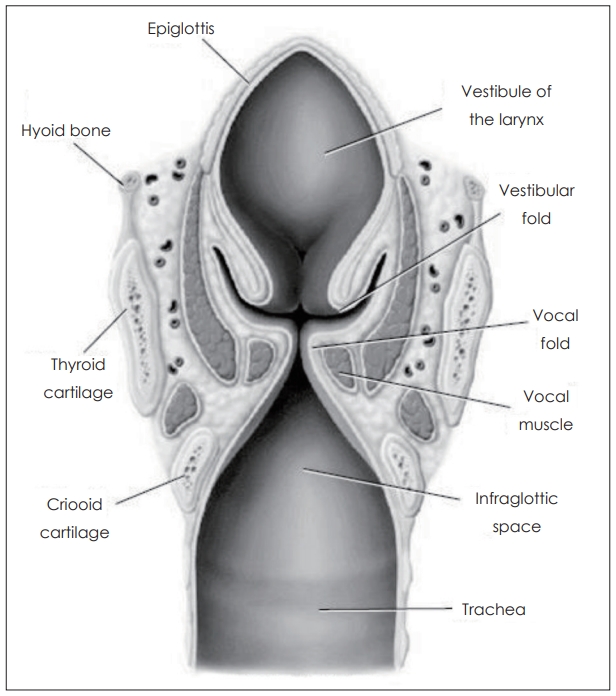
설기저부에서 인두는 후두로 나뉘는데, 후두는 연하 시 음식물이 기도로 넘어가는 것을 방지하는 기본적인 밸브역할을 한다. 후두의 가장 상부 구조물은 후두개이고 혀기저부의 상부 1/3~1/2에 위치하며, 설골 후두개인대에 의해 부착되어 있다. 설기저부와 후두개 사이의 쐐기모양의 공간을 후두개곡(valleculae)이라고 부른다. 후두개곡과 2개의 이상와(pyriform sinus)는 인두와라고도 알려져 있으며, 인두기가 유발되기 전이나 후에 음식물이 존재하는 곳이다. 후두의 입구는 후두전정이라고 불리고 후두개, 피열후두개주름, 피열연골로 경계 지어지고 가성대의 상면에서 끝이 난다. 피열연골은 연하 시 전방 전위를 하는데 이러한 움직임은 갑상피열근의 견인에 의한 결과이며 기도의 입구를 폐쇄하는데 기여한다. 가성대와 진성대 사이의 공간은 후두전정이라고 한다. 진성대는 성대근과 갑상피열근으로 구성되어있고, 이들은 뒤쪽으로는 피열연골의 성대돌기, 측면으로는 갑상연골판의 내면, 앞쪽으로는 갑상절흔에 부착한다. 이들은 내전 및 폐쇄에 의한 후두의 폐쇄에 효과적이며, 성대는 기도를 보호하는 마지막 구조물이다. 후두개와 피열후두개주름, 피열연골과 후두개 기저부와 가성대, 진성대는 연하시 인두로부터 후두를 완전히 폐쇄하는 역할을 하여 음식물 흡인을 막는 3개의 괄약근 역할을 한다(Fig. 1). 설기저부, 혀, 설골과 후두는 밀접한 해부학적 관계를 가지고 있으며, 한 구조물이 움직이면, 이에 연결되어 있는 구조물이 함께 움직이게 된다.
2. 정상 연하 과정
연하의 과정은 구강준비기, 구강기, 인두기 및 식도기로 나뉜다. 이 중 인두기는 정상 연하를 위하여 구개인두폐쇄(velopharyngeal closure)에 의한 역류방지, 후두폐쇄(laryngeal closure)에 의한 하부 호흡기 보호 및 오연 방지, 인두 수축에 의한 연동운동을 형성하여 식괴를 통과 시키고, 후두 상승(laryngeal elevation)과 전방 이동(anterior movement), 윤상인두근(cricopharyngeus muscle)의 이완이 일어난다. 이러한 인두의 움직임은 서로 밀접한 연관성을 갖는데 특히 후두 상승과 전방 이동은 후두를 설근부로 이동시켜 식괴의 경로를 벗어나게 하면서 윤상인두근을 외부로 당겨 cricoids lamina가 인두 후벽으로부터 분리되면서 입구가 넓어지고 근육이 이완되어 괄약근의 개방을 돕는다. 후두폐쇄는 복합적인 현상으로 폐쇄가 성대에서 시작하여 상부로 진행되어 가성대, 후두개, 피열후두개주름의 순서로 일어난다. 이 중 가장 중요한 것은 진성대가 폐쇄되는 동안 피열연골은 상방, 전방으로 기울어지고 설기저부는 후방으로 이동하여 성문을 폐쇄한다. 후두전정이 닫힌 후에도 후두개의 하방 전이는 완전하지 않고 3가지 운동의 힘이 완전히 이루어 진 후 성문 폐쇄에 관여하는데 이는 1) 식괴의 상방에서의 압력, 2) 피열후두개주름 근육 등의 하방 견인력, 3) 설기저부의 후방 이동과 후두 상승의 합동 작용에 의한다. 이러한 후두개에 의한 폐쇄는 식괴가 후두 전정 내로 들어가는 것을 방지하고 성대의 폐쇄는 음식물이 기관 내로 들어가는 것을 막아준다.
3. 갑상선암에서의 흡인
갑상선암은 2008년 국가 암 통계에서 전체 암 중 2위이고 남성 암에서는 6위, 여성 암에서는 1위로 점차 증가하는 추세이며, 수술이 치료의 근간이 된다[5]. 갑상선은 목의 중앙 전하부에 갑상연골과 윤상연골 하방에 위치함과 동시에 심경근막 아래 기관/식도 위에 위치한다. 반회후두신경(recurrent laryngeal nerve)은 양측 갑상선의 후면에 위치하고 있어, 진행된 갑상선암의 25~47%에서 침범이 있다고 보고된다[6]. 갑상선수술 전에 발생하는 성대마비는 원발 종양의 직접적인 침습 또는 기관주위 림프절의 전이에 의한 반회후두신경의 침습뿐만 아니라, 신경 침습 없이 압박에 의해서도 발생한다[7-9]. 수술 중 반회후두신경 손상은 주로 반회후두신경 가까이 위치하는 주변 조직에 매듭(tie)을 형성하고, 하갑상선 동맥의 결찰 시 반회후두신경을 함께 결찰하거나, 반회후두신경의 전방분지를 후방분지로 오인하여 결찰하거나, 갑상선을 과도하게 견인하는 과정에서 발생할 수 있다. 수술 중 반회후두신경의 손상으로 인하여 성대마비가 발생하게 되면, 음성이 쉬거나 약해지는 증상이 나타나고 경우에 따라 흡인이 될 수 있다. 일측 반회후두신경 마비시 일상생활에 호흡곤란이 있는 경우가 75%, 흡인장애 56%, 음성장애를 호소하는 경우가 80%로 보고되고 있다[10,11]. Nishida 등[12]의 연구에서 수술 전 성대 운동이 정상인 경우, 반회후두신경 침습이 있는 경우라도 신경을 보존한 그룹과 신경을 절제한 그룹 사이에 국소(local) 또는 부위(regional) 림프절 전이 및 생존율이 다르지 않았다. 수술 소견에서 반회후두신경의 침습이 발견되면, 수술 전 성대운동이 정상인 갑상선암은 반회후두 신경을 보존한 뒤 수술 후 갑상선 호르몬 억제요법, 방사성요오드 치료 또는 방사선 치료를 통해 치료하며, 수술 전 일측 성대마비가 있는 암은 침습된 부위의 신경을 절제하고 신경문합술을 시도할 것이 권고된다[13]. 또한 수술 중에 우발적으로 신경이 손상되거나 종양에 의하여 반회후두신경을 보전할 수 없는 경우에는, 수술 중 다음 2가지의 방법을 이용하여 회복을 기대할 수 있다: 1) 절제 원위부의 반회후두신경과 목신경고리의 운동 분지를 문합하는 방법(ansa cervicalis transfer), 2) 즉각적인 신경 이식을 하여 절제한 신경의 원위부와 근위부를 문합하는 방법(end-to-end anastomosis or cable graft)이다. 수술 후에는 성대 내전술(medialization)을 고려할 수 있다[13].
4. 구강, 인두, 후두암에서의 흡인
기존의 연구에서 두경부암 환자의 36~94%에서 흡인이 발생하며[14-18], 연하와 관련된 구조의 기능적 이상[19], 종양의 절제, 수술 중 발생하는 근육, 뼈 및 연골 등의 연하 관련 구조의 제거, 방사선 치료에 의한 반흔 조직의 형성 및 항암치료에 기인한 세포 사멸에 의한 구강, 인두, 후두 근육 움직임의 이상 등에[20,21] 의해 흡인이 유발하는 것으로 알려져 있다.
흡인의 발생 요인과 관련하여 일반적으로 성별은 큰 차이가 없으나 나이는 흡인의 발생과 밀접한 관련성을 갖는 것으로 알려져 있으며, 특히 Caudell 등은 두경부 암 환자의 치료에 있어 고령은 흡인의 발생을 예측할 수 있는 중요한 요소임을 주장하였다[22].
두경부암 환자에서 흡인의 발생은 시기에 대해 차이를 보일 수 있는데, Logemann 등은 항암치료 혹은 방사선 치료를 받은 두경부암 환자를 대상으로 시행한 연구를 통해 흡인은 치료 전과 치료 후 3개월에 높은 흡인 발생을 보임을 보고하였고[23], Petterson 등은 수술 전과 비교하여 술 후 3개월, 6개월, 12개월이 경과할 수록 흡인의 발생률은 점차로 증가한다고 보고하였다[24].
종양의 위치와 흡인과의 관련성에 대하여 Stenson 등은 구강암 환자의 30%, 후두암 환자의 67%, 인두암 환자의 80%에서 흡인이 발생한다고 분석하였고[25], Starmer 등은 후두 및 하인두로의 종양 침범이 흡인 발생의 주된 요인이라고 주장하였다. 반면에 Campbell 등은 두경부암 치료 후 5년 이상 생존한 환자를 대상으로 한 조사를 바탕으로 종양의 위치는 흡인의 발생과 무관하다는 상반된 결과를 보고하기도 하였다[26].
Nguyen 등 및 Chapuy 등에 의해 항암치료 및 방사선 치료를 시행받은 구인두암 환자를 대상으로 한 연구를 통해 T1, T2의 병기보다 T3 또는 T4의 병기에서 흡인의 발생이 높음을 보고되었다[27,28]. 또한 Jung 등이 시행한 종양의 크기, 림프절 병기 그리고 AJCC 병기와 흡인과의 관계에 대한 연구에 따르면 이들 중 AJCC 병기가 흡인과 관련된 가장 밀접한 관련을 보인다고 하였으나[3], 반대로 Stenson 등은 AJCC 병기는 흡인 발생과의 밀접한 관련이 없다고 주장하였다[29].
수술과 관련하여 기존의 연구에 따르면 설 절제술을 받은 환자의 10~37%에서[30], 성문상부 후두절제술을 시행 받은 환자의 50~67%에서[31] 흡인이 발생한다고 알려져 있다. 또한 수술적 치료를 받은 두경부암 환자의 경우 흡인의 발생은 수술적 치료를 받지 않은 환자에 비해 유의할 만한 높은 흡인 발생률을 보이며 이는 수술 후 증가된 인두 잔여물 증가와 관련이 있다[3,32].
항암화학치료 역시 흡인 발생의 예측 인자로 작용하는데, Nguyen 등의 결과에 따르면 항암화학치료 이후 흡인의 발생률은 17%에서 59%로 상승하였다고 하며[33], 항암화학치료 후 발생하는 점막염, 설염, 섬유화 그리고 림프부종이 이를 악화시킬 수 있다[34]. 또한 방사선치료를 받은 비인두암 환자에서 75%에서 구인두 기능 부전이 관찰되고, 87.1%에서 연하반사의 지연이, 93.5%에서 후두곡 잔유물이, 그리고 82.8%에서 불충분한 인두 수축이 관찰되며 이들 요소가 방사선 치료 후 흡인의 발생과 관련이 있다고 알려져 있다[35]. 특히 Pauloski 등은 방사선치료가 흡인 시 후두곡 잔유물(valleculla remnants)을 증가시켜 흡인의 발생을 35% 증가시킴을 보고하였고[36], 이는 방사선 치료에 따른 연하 관련 구조의 섬유화와 근 움직임의 저하에 기인하며, 방사선 치료를 단독으로 받은 환자에서 보다 항암 화학치료와 방사선 치료를 함께 받은 환자에서 흡인이 보다 빈번하게 발생한다는 보고를 하였다[34,37].
이러한 결과를 한국 환자에 맞추어 잘 정리한 논문이 보고되고 있는데, 그 결과에 따르면 유의한 의미를 가지는 요인으로는 ① 65세 이상, ② AJCC stage III-IV 이상, ③ 수술(Operation) 여부, ④ 항암치료(Chemotherapy) 여부 등을 보고하고 있다[3]. 결과적으로 여러 가지 요소 중 고령, 높은 종양 병기, 그리고 수술 및 항암화학요법의 시행 여부가 두경부암 환자에서 발생하는 주된 위험 요소로 작용할 수 있다.
결 론
두경부암 환자의 수술적 및 항암·방사선치료 후 발생하는 연하장애 및 흡인의 특징은 제거된 종양의 원발부의 위치 및 접근방법, 재건방법, 술 후 병합치료 여부 등에 따라 서로 다른 형태의 연하장애를 보일 수 있다. 따라서 종양의 위치, 병기, 수술, 항암화학 및 방사선치료 여부를 종합적으로 고려하고 VFSS 및 내시경 등의 이학적 검사를 통한 흡인의 발생 원인 및 기전에 대한 면밀한 검사를 통한 빠른 진단과 재활 계획 등이 필요하다.