후두의 염증성 근섬유모세포종으로 진단받은 환자 2례
Laryngeal Inflammatory Myofibroblastic Tumor : Case Series and Literature Review
Article information
Trans Abstract
Inflammatory myofibroblastic tumor (IMT) is a rare benign tumor, that is composed of myofibroblastic spindle cells with inflammatory cells. IMTs usually occur in lungs, intestine organs, orbits and paranasal sinuses, however, it may rarely be seen in the larynx. We present two cases of patients with laryngeal IMT that had different causes and prognosis.
서 론
염증성 근섬유모세포종은 방추 세포 증식과 염증 세포 침윤을 특징으로 하는 양성 종양이다[1]. 전 연령 층에서 발생할 수 있으나, 주로 소아나 젊은 성인에서 자주 발생한다. 양성 조직학적 소견을 보이지만 드물게 국소 전이 및 재발 경향이 있으며, 명확한 자연 경과에 대해 밝혀져 있지 않다. 또 드물게 임상적으로 악성 종양과 같은 성향을 보인다는 보고들이 있어, 악성 종양과의 감별을 위해 절제 생검이 우선적으로 필요하다[1-3]. 발병 원인은 감염(infectious), 신생물(neoplasm), 수술 및 외부 자극에 의한 반응(reactive), 면역학적 요소(immunological factors) 등이 있을 수 있다[3,4]. 일반적으로 폐에 발생하는 것이 가장 흔하며 비장, 간, 장간막, 비뇨생식계, 망막 등에서도 발생하나 두경부 영역에서의 발생은 드문 것으로 알려져 있으며, 진단은 절제 생검이 일반적이다[4,5].
저자들은 최근 목소리 변성을 주소로 내원한 18세, 66세 남자 환자에서 서로 다른 원인과 경과를 보인 후두 염증성 근섬유모세포종 2례를 경험하였기에 문헌 고찰과 함께 보고하는 바이다.
증 례
1. 증례 1
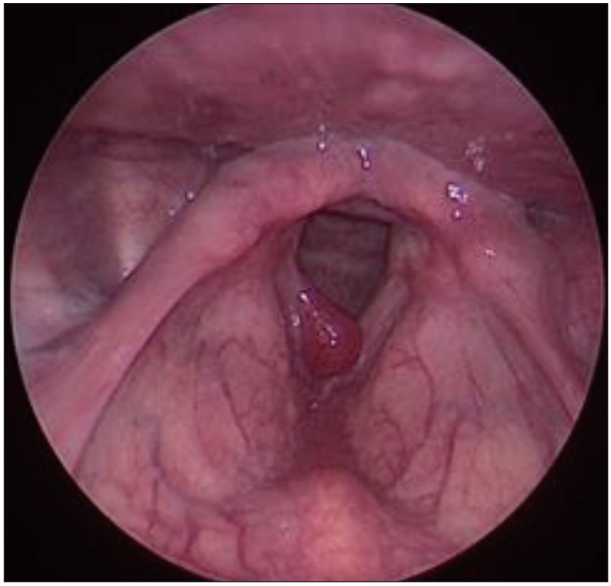
18세 남자 환자가 1년 전부터 서서히 시작된 목소리 변화를 주소로 내원하였다. 내원 당시 호흡곤란, 식이 장애, 후두 이물 감 및 전신 증상은 보이지 않았다. 과거력으로 흡연, 음주력 없으며, 특이 기저 병력 및 가족력은 없었다. 외래에서 시행한 후두경 검사상 우측 진성대 전-중방부에 용종 모양 혈성 종물이 확인되었다(Fig. 1). 이는 스트로보스코피에서 성대의 불완전 폐쇄, 우측 점막 파형의 부분적 감소, 우측 전방부 무진동 부위 소견 보였고 수술 전 감별진단으로 성대 폴립을 염두 해 두고 후두미세수술을 통한 절제 생검을 진행하였다. 수술 장 소견은 용종 형태의 출혈성 종물이 우측 진성대 전방부에 있으며 고유층의 상층까지 침범해 있는 소견을 보였다.
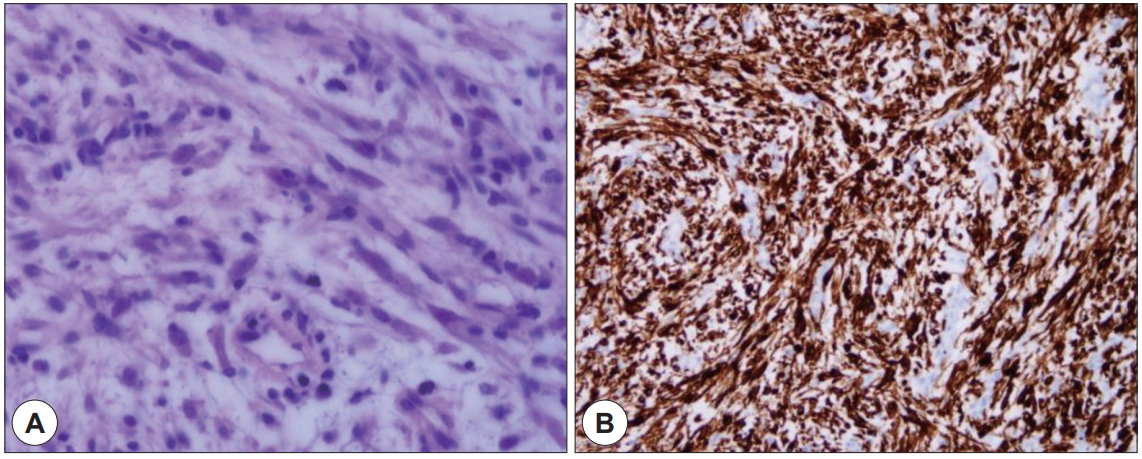
병리 소견상 비정형 방추 세포와 림프형질 세포성 염증세포가 관찰되었고(Fig. 2A), 면역조직화학적 검사에서 Anaplastic lymphoma kinase(ALK), Smooth Muscle Actin(SMA)양성(Fig. 2B)을 보여 염증성 근섬유모세포종으로 진단하였다. 수술 후 목소리는 정상으로 회복되었으며, 현재 수술 후 6개월째 재발 없이 외래 통한 경과 관찰 중이다.
2. 증례 2
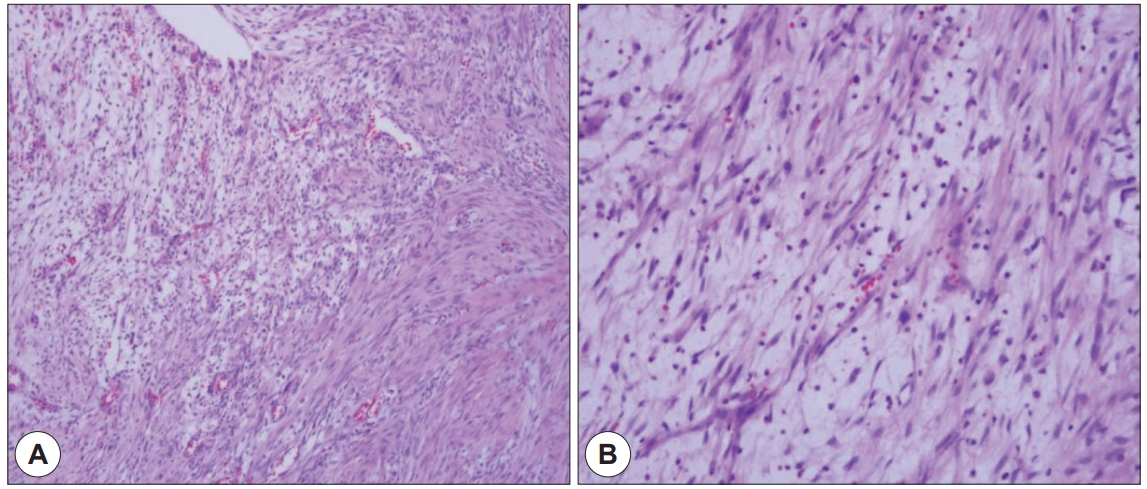
66세 남자 환자가 6개월 전부터 서서히 심해지는 목소리 변화를 주소로 내원하였다. 과거력상 당뇨, 고혈압 있으며, 흡연력(10갑년), 음주력(5회/주)있었고, 기타 특이 기저 병력 및 가족력은 없었다. 외래에서 시행한 후두경 검사상 우측 성대 전연부 백반증 소견 보였다(Fig. 3A). 후두 스트로보스코피에서 성문 폐쇄의 불완전, 우측 부분적 무진동 부위가 관찰되었다. 수술 전 혈액검사에서 특이 소견 보이지 않았다. 수술 전 감별 진단으로 성대 백반증 및 악성 종양 가능성 의심하며 레이저 후두미세수술 통한 절제 생검 시행하였다. 병리 검사에서 HPV에 의한 고분화 이형성(High grade dysplasia with human papilloma virus) 보여 외래 통한 경과 관찰 하기로 하였다. 환자는 2개월 마다 외래 경과 관찰 중 재발 없이 지내오다가 수술 6개월이 지난 시점에 갑작스런 목소리 변화를 호소하며 내원하였다. 후두경 검사상 이전 병변과 동일 위치에 1×1.5 cm 크기의 난원형 종물이 관찰되었고(Fig. 3B), 호흡곤란 등의 증상이 있어 후두미세수술을 재시행하였다. 수술장 소견상 우측 진성대 전방과 가성대에 걸쳐 자리 잡은 육아종성 병변이 관찰되었고, CO2 레이저를 이용해 제거 후 스테로이드를 병변에 주입했다. 면역조직화학 검사에서 Smooth Muscle Actin(SMA)에 약한 반응성을 보였으며, Anaplastic lymphoma kinase(ALK)는 음성 소견을 보였다. 병리 소견상 방추 세포의 증식, 염증세포침윤 및 근섬유모세포가 섞여있어 염증성 근섬유종으로 진단 하였다(Fig. 4). 이후 경과 관찰하던 중 재수술 4개월 후 다시 목소리 변화 발생하여 외래 내원하였다. 후두경 검사상 동일 부위인 우측 전연합부에 난원형 모양의 종물이 확인되었다(Fig. 3C). 호흡곤란 증상이 심하지 않아 스테로이드 복용하며 경과 관찰하였으나, 경과 관찰 2주 후 종물 크기 커지는 것을 확인하고 후두미세수술을 진행하기로 하였다. 수술 전날 환자 기침하는 중에 스스로 1.5×1.5 cm의 종물을 뱉어 내원하였으며, 연성 후두경 검사상 우측 전연합부 종물이 깨끗이 제거된 것 확인하였다(Fig. 3D). 환자의 추가적 검사 거부로 제거된 종물에 대한 병리조직검사는 진행하지 못했다. 현재 환자는 8개월 동안 재발 없이 추적관찰 중이다.
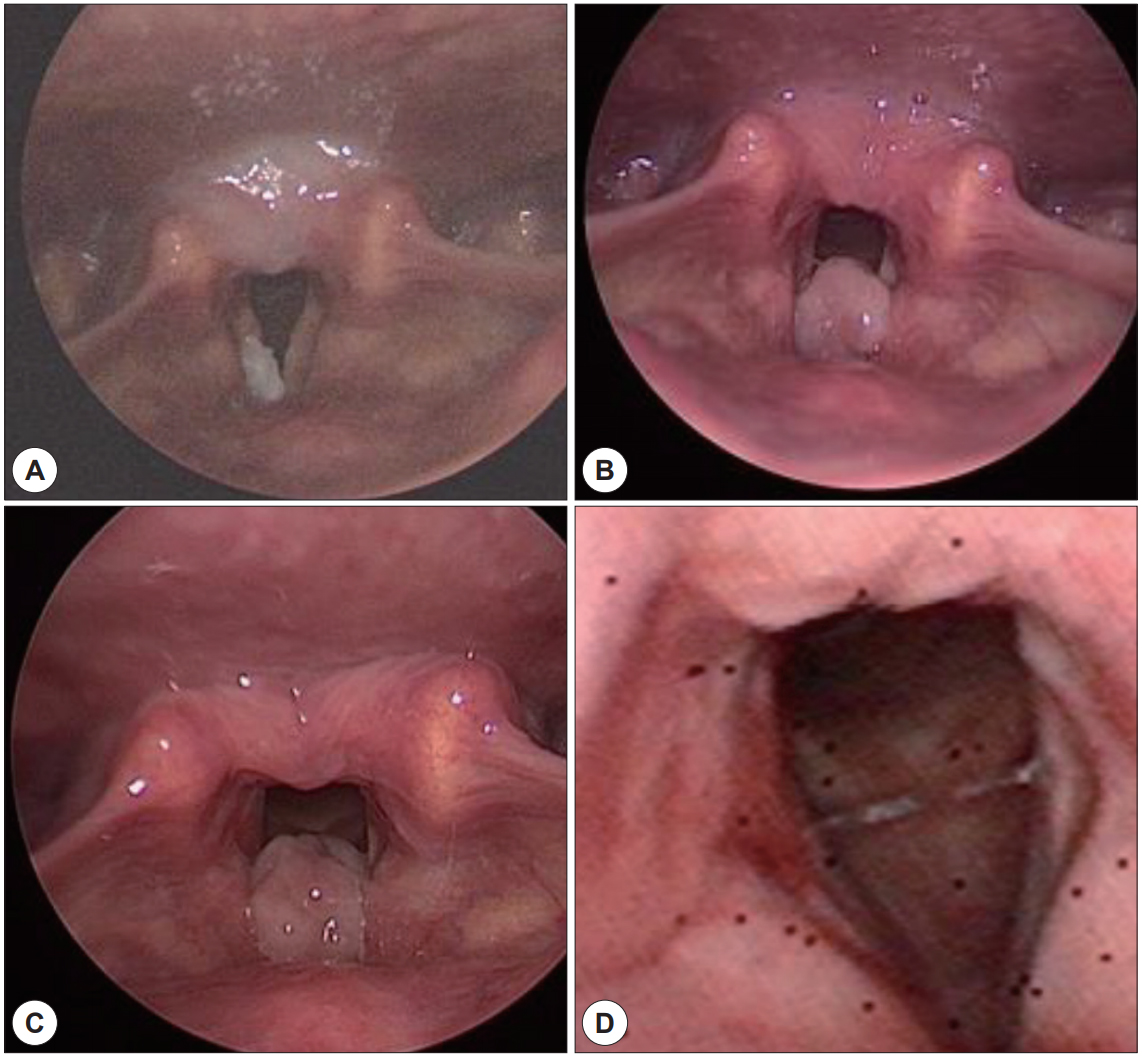
Laryngoscopic findings. A : Leukoplakia on right vocal cord, B : Inflammatory myofibroblastic tumor (IMT) at postoperative 6 months, C : IMT recurrence at postoperative 10 months, D : Last follow up status.
고 찰
염증성 근섬유모세포종은 방추 세포와 염증 세포로 구성되어있다. 종양은 형질 세포 육아종, 양성 근육세포모세포종, 염증성 섬유육종 등의 용어로 정의되기도 한다[6]. 최초로 폐에서 발견된 것으로 보고 되었으며, 이후 안구, 비장, 간, 비뇨생식관, 복부장기, 두경부까지 전신에서 발생 가능한 것으로 보고된다[7]. 일반적으로 양성 종양으로 알려져 있으나 재발 및 약 5% 이하 에서 드물게 전이된 보고가 있으며, 이러한 특징으로 임상적으로 악성종양으로 보고된 바 있다[1,10]. 원인은 감염, 신생물, 외부 자극, 면역학적 요소 등이 있을 수 있으며, 담배는 발생 원인으로 보고 되나 음주 및 방사선 노출은 연관성이 낮은 것으로 판단된다[2-4].
면역조직학적 검사에서 염색체 2p23과 p80의 재배열에 의한 ALK의 발현이 50~70%에서 염증성 근섬유모세포종 발생과 관련 있다[2-4,7,8]. 증례 1의 경우 면역조직학적 검사에서 ALK 재배열을 확인 할 수 있었으며 면역학적 요소에 의한 신생물로 판단된다. 증례 2의 경우 ALK 재배열, EBV 모두 음성 소견 보였으나 병리소견 상 수술에 의한 자극성 반응 및 감염에 의해 발생한 경우라고 할 수 있겠다[9]. 수술 수개월 이후 지속적으로 재발하는 것으로 보아 적극적인 경과 관찰을 해야 한다. 또한 재발로 인한 추가적 치료에 대해 미리 환자에게 설명하고 치료를 이어가는 것이 중요하다.
후두에 발생한 염증성 근섬유모세포종의 증상으로는 목소리 변성(74%)이 가장 흔하며, 천명(29%), 호흡곤란(22.5%) 및 이물감(16%) 등이 있다[3]. 전신 증상은 체중감소, 불명 열, 저색소 및 소적혈구 빈혈, 혈소판 증가증이 나타나기도 한다[5]. 본 두 증례에서는 목소리 변화 증상 및 후두 이물감을 호소하였으며 다른 증상 및 혈액학적 소견은 보이지 않았다. 진단은 후두경으로 직접 확인 하는 것이 가장 우선이다. 이후 종양의 크기나 위치, 환자의 증상에 따라 보조적으로 영상의학적 검사를 고려할 수 있다. 최종 진단은 후두미세수술을 통한 절제 및 생검을 통해서 확진할 수 있다. 감별해야할 진단으로는 성대 폴립, 성대 결절, 성대 낭종, 성대 육아종 등이 있으며 재발 여부, 모양, 경과에 따라 악성종양 감별이 필요하다[3,6]. 표준 치료는 후두미세수술을 통한 완전 절제며, 완전 절제에 의한 기능 손상 및 완전 절제가 어려운 경우 스테로이드 투여나, 화학, 방사선 치료를 고려 해볼 수 있다[1,6,7]. 특히 증례 2에서와 같이 완전 절제를 충분히 하였음에도 재발하는 경우 역시, 재수술을 통한 완전 절제가 필요하다. 하지만 환자의 순응도 및 병변의 경과를 고려해서 추가적인 치료 방법을 선택해야 한다. 수술 위험도가 높거나 수술 후 기능 상실이 우려되는 경우 펄스 스테로이드를 사용해보는 것도 도움이 될 수 있다[1,5].
재발율은 15~30% 정도로 보고되며, 대부분 불완전 절제로 인한 재발이 가장 흔하다[7,10]. 본 증례에서와 같이 동일 부위에 재발하는 경우 수술 전 환자에게 예후와 재발 가능성에 대하여 충분히 설명해야 한다. 또한 추적관찰을 통해 재발 및 악성으로의 변화를 면밀히 관찰하는 것이 필요하다.
후두 염증성 근섬유모세포종은 비교적 양성의 경과를 보이는 질환으로 수술적 절제 후 추적 관찰에 소홀하기 쉽다. 하지만 본 증례 에서와 같이 다양한 원인에 의해 발생하며, 그 경과 역시 국소 침윤, 재발, 악성으로의 변화 등의 다양한 임상 경과를 보이므로 이를 고려하며 적절한 추적관찰에 주의를 기울여야 할 것이다.
Notes
This work was supported by Inha university research grant.