AbstractBackground and ObjectivesVoice problems after menopause are caused by extracellular matrix (ECM) changes in the vocal fold lamina propria. Echinochrome A (ECH), which is known to a strong anti-oxidant, was injected into ovariectomized rats (OVX) to evaluate the effect on the ECM of the vocal fold lamina propria.
Materials and MethodSprague-Dawley female rats were randomly divided into three groups as follows: group I (sham-operated rats, SHAM), group II (OVX), group III (ovariectomized rats injected with ECH, OVX+ECH). Rats were sacrificed 12 weeks after ovariectomy.
ResultsECH treatment had no effect on the levels of estradiol and expression of estrogen receptor β in vocal fold. The expression of Has2 and Has3 were decreased in the OVX and increased with ECH treatment. The expression of Col1a1, Col1a2, and Col3a1 were decreased in the OVX group, but significantly elevated in the OVX+ECH group. The expression of Eln was decreased in the OVX group, but the level of Eln increased in the OVX+ECH group. The expression of matrix metalloproteinases (MMP)-1, 8, and 9 was increased in the OVX group, but the expression of MMP-1 and 8 were decreased after ECH treatment. ECH treatment had no effect on 4-hydroxynonenal in vocal fold, superoxide dismutase, catalase, and glutathione peroxidase were decreased in the OVX and increased with ECH treatment.
서 론성 호르몬(sex hormone)은 성대의 활동과 음성 생성에 영향을 미치는 주요한 요인이다. 2차 성징인 목소리는 남성과 여성에 따라 다르며 성적 성숙(sexual maturation)에 따라 변한다. 여성의 목소리는 여성 호르몬의 변화와 밀접한 관련이 있다. 후두의 변화는 가임기(reproductive years) 동안 월경 주기(menstrual cycle)와 함께 체계적으로 변동하여 일생동안 음성 변화에 영향을 미친다[1,2].
일반적으로 음성 생성(voice production)에는 성대고유층에 있는 세포외기질(extracellular matrix, ECM)의 구성 성분이 중요하다. 성대고유층(lamina propria)의 ECM은 콜라겐(collagen), 엘라스틴(elastin), 피브로넥틴(fibronectin)과 같은 간질 단백질(interstitial proteins), 히알루론산(hyaluronic acid)과 같은 글리코사미노글리칸(gycosaminoglkycans)으로 구성된다[3]. 이러한 ECM 구성 요소는 중요한 생화학적 기능을 가지며 성대 기능에 기여한다. ECM 구성 성분들은 성대 점탄성(viscoelasticity)을 결정하는데 중요한 역할을 하며 발성역치 압력(phonation threshold pressure) 및 음성 기본 주파수(vocal fundamental frequency) 등과 같은 음성 기능에도 영향을 미친다[4,5].
폐경기(menopause) 동안 에스트로겐의 양이 감소하면 ECM의 생성과 분해에 변화가 발생하여 성대 진동에 변화가 발생한다. Kim 등[6]은 성대고유층은 에스트로겐(estrogen)에 민감한 기관이며, 폐경과 같이 신체의 에스트로겐이 감소하면 성대고유층을 구성하는 ECM 구성성분의 변화가 발생한다고 하였다. 호르몬 요법(hormone therapy)은 여러 폐경기 증상의 치료 및 음성 변화를 완화시키는 데에 도움이 되지만, 장기간 호르몬 치료의 단점이 있어 아직 논란이 있다[7-9].
Echinochrome A (6-ethyl-2,3,5,7,8-pentahydroxy-1,4-naphthoquinone, ECH)(Fig. 1)는 성게(Saphechinus mirabilis) 에 주로 함유되어 있는 성분으로 미토콘드리아 생합성 조절을 통한 항산화 기능을 하는 2,3,7-하이드록실 그룹(2,3,7-hydroxl group)을 가지고 있는 강력한 항산화 물질이다[10]. 활성 산소(free radical)에 의한 산화 스트레스(oxidative stress)는 성대 상처의 치유나 성대 노화에 관여하는 것으로 알려져 있으며, 항산화제는 성대 상처 모델이나 성대 노화 모델에서 ECM 구성 성분의 개선에 도움이 된다고 알려져 있다[11,12].
그래서 저자들은 ECH의 강력한 항산화 효과는 폐경 후 발생하는 성대고유층의 ECM 구성 성분의 변화에 영향을 줄 것으로 생각하였다. 본 연구자들은 이전 연구를 통하여 폐경을 모방하기 위해 난소 절제한 암컷 쥐에게 6주간 ECH를 단기 투여하여 에스트로겐 결핍에 의해 유발한 성대고유층의 ECM 구성 성분의 변화가 ECH 투여 후 개선됨을 확인하였다[13]. 본 연구에서는 같은 동물 모델에서 ECH의 장기간 사용 효과를 검증하기 위해 난소를 절제한 쥐에 ECH를 12주간 투여하여 ECH의 장기 투여에 따른 성대고유층의 ECM 구성 성분 변화를 확인하였다.
대상 및 방법동물 모델본 연구를 위한 동물 모델은 부산대학교 생명윤리위원회로부터 승인받았다(PNU-2017-1428). Sprague Dawley (중앙실험동물) 종의 쥐는 평균 수명이 30개월 정도로, 성적 성숙에 이르는 9주령 이후의 암컷 쥐 24마리를 항균 상태에서 12시간 명암주기(light/darkness cycle) 조건 하에서 먹이와 물을 충분히 주면서 사육하였다. 암컷 쥐는 1주일간 무균실에서 순응시킨 후 무작위로 3그룹으로 나누어, 비수술군(shamoperated rats, SHAM), 난소 절제 수술군(ovariectomized rats, OVX), 그리고 난소 절제 수술 후 12주 동안 ECH를 주사한 군(OVX+ECH)으로 분류하였다. 난소절제 수술군은 흡입 마취 후 복부 절개하여 난소를 제거하고 절개부는 봉합하였다(OVX group). 대조군 설정을 위하여 비수술군은 복막 절개 단계까지 난소절제 수술과 같은 방법으로 시행하고, 난소를 절제하지 않고 다시 봉합하는 모의 수술(SHAM group)을 시행하였다. ECH는 OVX 수술 후 10 mg/kg 용량으로 1주일에 3회씩 12주간 복강 주사하였다(ECH group). 모든 실험 그룹은 일주일에 1회 체중 및 먹이 섭취량을 측정하였다. 혈액은 채취하여 4°C에서 1시간 응고시킨 후 원심분리(4200 rpm, 20분, 4°C)하여 혈청을 얻었고, 조직표본 제작용 실험조직은 4% 파라포름알데히드(paraformaldehyde) 용액으로 고정하였으며, 분자생물학용 실험조직은 액체질소에 급속 냉동하여 -80°C에 보관하였다.
조직 표본 염색성대를 포함하는 후두 조직은 4% 파라포름알데히드 용액에 보관 후 탈수하였고 파라핀 임베딩(Leica TP1020, Semienclosed benchtop tissue processor, Leica, Wetzlar, Germany) 및 디스 펜싱(Leica EG1150H, Heated paraffin embedding module, Leica)을 위해 자동조직공정(automatic tissue processor) 을 사용하여 파라핀블럭(paraffin block)을 4 μm 두께로 슬라이드로 제작하였다. 염색 분석을 위해 슬라이드를 자일렌(zylene)으로 탈파라핀화한 다음 에탄올과 물로 일련의 세척을 통해 수화하였다. 각 성대 조직의 엘라스틴 섬유 밀도를 비교하기 위해 Verhoeff’s elastin 염색을 하였으며, 히알루론산(hyaluronic acid) 변화를 비교하기 위해 알시안블루 염색(Alcian blue staining)을 하였다.
면역조직화학 염색탈파라핀화 된 조직 슬라이드는 일차 항체로 anti-hyaluronic acid, anti-collagen I, anti-collagen III, anti-elastin, anti-4-hydroxynonenal (4-HNE), anti-catalase (CAT) anti-superoxide dismutase (SOD) (1:400) (Abcam, Cambridge, U.K.)를 사용하여 각각 4°C에서 24시간 동안 반응시켰다. 일차 항체를 세척한 후, 섹션을 실온에서 1시간 동안 이차 항체에 반응시켰다. Goat-anti rabbit secondary antibodies (1:1,000) (ENZO Biochem, Farmingdale, NY, USA)를 이중 염색 목적에 사용하였다. 일차 항체 대신 PBS를 사용하는 것을 음성 대조군으로 사용하였다.
실시간 중합효소 연쇄반응 검사성대 고유층을 분리하여 Trizol 시스템(Life Technologies, Rockville, MD, USA)을 이용하여 RNA를 추출하였다. 정제된 RNA를 cDNA 합성을 위해 Nanodrop-1000 분광 광도계(Thermo Scientific, Wilmington, NC, USA)를 사용하여 RNA를 정량화 하였다. AccuPower CycleScript RT Premix(Bioneer, 대전, 대한민국)를 사용하여 Peltier Thermal Cycler PTC-200 (Roche, Indianapolis, IN, USA)에서 37°C에서 1시간 동안 cDNA를 합성하였다. 실시간 중합효소 연쇄반응(real-time quantitative polymerase chain reaction, RTqPCR) 은 SYBR Green PCR 프로토콜(Applied Biosystems, Foster City, CA, USA)에 따라 수행하였다. 각 샘플은 다섯 번 반복 실험하였다. 유전자 특이적 PCR 산물은 ABI PRISM 7900 HT 서열 검출 시스템(PE Applied Biosystem Norwalk, CT, USA)에 의해 지속적으로 측정하였다. Primer의 염기 서열에 대한 정보는 Table 1과 같다.
관찰 방법 및 통계 분석성대고유층의 ECM 분석을 위해 성대의 중간 부분을 선택하여 대표 사진을 획득하였다. 광학 현미경으로 구성된 이미지 분석 시스템 프로그램(Leica Basic LAS V3.8 software, Leica)을 사용하여 40배 배율로 획득한 성대고유층의 현미경 사진을 이용하였다. 통계 측정은 GraphPad (GraphPad Software version 5.0 Inc., San Diego, CA, USA) 프로그램을 사용하여 Mann-Whitney U test로 통계 분석하였으며, p-value가 0.05 미만인 경우를 통계학적으로 유의한 것으로 간주하였다.
결 과에스트로겐 수용체의 발현과 혈청 에스트로겐 농도에 대한 ECH의 효과먼저 난소절제술에 의한 폐경이 유도되었는지 확인하기 위하여 혈청 에스트로겐의 농도를 검토하였다(Fig. 2A). 혈청에 스트로겐 농도는 SHAM 그룹에 비하여 OVX 그룹과 OVX+ECH 그룹 모두에서 유의하게 감소하였으며, OVX 그룹과 OVX+ECH 그룹 사이에는 차이가 없었다. 또한 성대고유층에서 에스트로겐 수용체의 발현이 OVX 그룹과 OVX+ECH 그룹에서 어떻게 변화하는지 확인하기 위해 에스트로겐 수용체에 대한 면역조직염색을 시행하였으나 에스트로겐 수용체는 각 그룹간의 차이가 없었다(Fig. 2B). 또한 에스트로겐 수용체를 인코딩하는 유전자인 Esr2a와 Esr2b의 mRNA 발현을 real time qPCR로 확인하였으나, 에스트로겐 Esr2a와 Esr2b의 유전자 발현 역시 모든 그룹에서 의미있는 차이가 관찰되지 않았다(Fig. 2C).
히알루론산 및 히알루론산 합성효소에 대한 ECH의 효과성대 고유층에서 히알루론산(hyaluronic acid)의 농도를 측정하기 위하여 알시안블루 염색과 면역염색(Fig. 3A)을 수행하였다. 성대고유층에서 히알루론산은 성대 전체에 고르게 분포되어 있는 것으로 나타났으며 그룹 사이에서 유의한 차이는 관찰되지 않았다. 그러나 real-time qPCR로 히알루론산 합성효소(hyaluronic acid synthase, Has)의 세가지 isoforms을 분석한 결과, Has1 유전자의 발현은 SHAM군 보다 OVX군과 OVX+ECH군에서 약간 저해되었으나 통계적 유의성은 없었고, 또한 OVX군과 OVX+ECH군 사이에도 의미있는 차이는 없었다. 그러나 Has2 및 Has3의 mRNA 발현은 OVX군과 OVX+ECH군에서 대조군에 비해 의미있게 감소하였지만, OVX군과 OVX+ECH군 사이에는 의미있는 차이는 관찰되지 않았다(Fig. 3B).
콜라겐 및 콜라겐 전구체에 대한 ECH의 효과성대 고유층 ECM의 주요 구성물질인 콜라겐 I (Collagen type I) 및 콜라겐 III (Collagen type III)의 발현을 확인하였다. 면역조직염색에서 콜라겐 I과 콜라겐 III 단백질의 발현이 SHAM군에 비해 OVX군에서 감소하였지만, OVX+ECH군에서는 증가하였다(Fig. 4A). 이어서 콜라겐 I을 인코딩하는 콜라겐 전구체인 Col1a1과 Col1a2, 그리고 콜라겐 III를 인코딩하는 Col3a1의 mRNA 발현을 real-time qPCR로 확인하였다. 그 결과, Col1a1과 Col1a2, 그리고 Col3a1은 SHAM군에 비해 OVX군에서 유의하게 감소하였으나 OVX+ECH군에서는 OVX군에 비해 의미있게 증가하였다(Fig. 4B).
기질금속단백질분해효소(Matrix metalloproteinases, MMPs)에 대한 ECH의 효과성대고유층을 구성하는 여러가지 ECM을 분해에 작용하는 기질금속단백질분해효소(MMPs)의 발현을 real-time qPCR로 확인하였다. 결과를 확인하면, SHAM군에 비해 OVX군에서 MMP-1, 8, 9가 유의하게 증가하였다(Fig. 6). 그러나 OVX+ECH군에서는 OVX에 의해 증가된 MMP-1과 8의 발현을 유의하게 감소시킴을 확인할 수 있었다.
산화스트레스 관련 지표 및 산화-환원 전이에 대한 ECH의 효과성대 고유층의 ECM에서 산화 스트레스 관련 지표(redoxrelated biomarkers) 및 산화-환원 전이(redox cascade)에 관여하는 효소의 발현을 확인하였다. 대표적인 산화 환원 관련된 표지자(redox-related biomarkers)인 지질과산화물의 지표인 4-HNE을 성대 고유층에서 면역조직염색을 시행하였으나 4-HNE는 각 그룹간의 차이가 없었다. 이어서 체내 항산화물질이자 산화 환원 연쇄 반응(redox cascade)에 관여하는 효소인 SOD와 CAT를 면역조직염색으로 성대 고유층에서 확인하고, SOD, CAT, 글루타치온 퍼옥시데이즈(glutathione peroxidase, GPX)의 mRNA 발현을 real-time qPCR로 확인하였다. 그 결과, SOD와 CAT의 면역염색발현이 SHAM 군에 비해 OVX군에서 감소하였지만, OVX+ECH군에서는 증가하였으며(Fig. 7A), SOD, CAT, GPX의 mRNA 발현이 SHAM군에 비해 OVX군에서 유의하게 감소하였으나 OVX+ECH군에서는 OVX군에 비해 의미있게 증가하였다(Fig. 7B).
고 찰여성 성호르몬은 후두와 성대에 영향을 주어 목소리 생성에 영향을 준다고 알려져 있으며, 여성 목소리의 급격한 변화는 폐경기에 발생한다. 폐경 이후 여성의 음성은 낮은 기본 주파수와 음성 주파수 섭동 범위(vocal frequency perturbation range)에 제한이 있다[1,2]. 이러한 변화는 가수나 성우와 같은 직업으로 목소리를 사용하는 여성에서 사회생활에 영향을 준다. 본 연구자들은 난소 절제술을 받은 쥐에서 성대고유층에서 에스트로겐 감소에 의한 ECM 생성 및 분해의 영향을 보고하였다[6].
폐경 후 에스트로겐 감소에 의한 여러 기관의 생물학적 기능 감소는 폐경기 증상을 유발하고, 이러한 폐경기 증상은 에스트로겐 투여에 의해 도움이 된다. 호르몬 요법은 여러 폐경기 증상을 완화시키기 위해 오랫동안 사용되어 왔으며, 또한 에스트로겐 대체 요법은 폐경 후 발생하는 음성 변화에도 도움이 된다[13,14]. 폐경 후 에스트로겐 대체 요법을 받은 여성에서 목소리의 호전이 관찰되고, 특히 에스트로겐 대체 요법은 음성을 전문으로 많이 사용하는 직업군에서 폐경에 따른 목소리 변화를 예방하는데 사용될 수 있다. 그러나 에스트로겐 대체 요법의 안전성에 대해서는 아직 논란이 있다[7]. 따라서 폐경 후 발생하는 폐경기 증후군의 증상을 완화시키기 위한 다양한 대체 요법(미네랄, 비타민 보충제, 식물성 에스트로겐, 천연 호르몬 및 식물 화학 물질 등)이 연구되고 있으나 폐경 후 음성 변화에 대한 대체 요법은 아직 많은 연구가 없는 실정이다[14,15].
ECH는 성게에서 추출한 물질로 강력한 항산화제로 여러 생물학적 효과가 보고되었다. 동물 실험 모델에서 ECH는 포도당 농도, 지질 과산화를 감소시키며, 간에서 인슐린, 산화질소 및 내인성 항산화 효소의 수준을 증가시키고[16] 심장에서 미토콘드리아 기능을 향상시켜 심근 허혈/재관류 손상에 대한 보호 효과와 심근 경색의 크기를 최대 45%까지 감소시키는 효과가 있으며[17], 폐경 이후에 발생하는 침샘의 기능 저하에 의한 구강건조증의 예방 효과도 보고되었다[18].
자외선 B (ultraviolet B, UVB)에 노출시키거나 블레오마이신(bleomycin)으로 유도한 피부경화증(scleroderma)에서는 UVB와 블레오마이신에 의해 증가한 콜라겐이 ECH에 의해 분해되어 피부 손상을 억제한다는 보고가 있다[19,20]. 강력한 염증과 피부섬유화 유발 물질인 UVB와 블레오마이신에 의한 초기 염증 유발 단계에서는 조직의 재생과 치유를 위해서 염증성 신호와 세포들이 조직에 집중적으로 모이기 때문에, 콜라겐의 생성이 증가할 수 있다. 그러나 본 연구에서 OVX군에서 확인된 성대고유층의 콜라겐 감소는 폐경에 의한 에스트로겐의 장기간의 결핍에 의하여 콜라겐 생성 능력 저하와 콜라겐 섬유들의 분해로 인하여 만성적으로 걸쳐 일어난 것으로, ECH의 12주간 장기 투여를 통한 폐경에 의한 성대고유층 손상에서 점진적인 기능 회복에 대해 관찰하고자 하는 본 연구자들의 연구와는 차이가 있다고 생각되어진다. 본 연구자들은 이전 연구에서 폐경 동물에서 성대고유층의 ECM 생성 및 분해와 관련된 유전자 발현의 변화를 관찰하고, 6주간 ECH 투여 후 ECM 생성 및 분해와 관련된 유전자의 변화를 관찰한 바 있다[13]. 따라서 본 연구에서는 12주간 ECH를 장기 투여하여 6주간 투여와의 결과를 비교하고자 하였다.
혈청 에스트로겐 농도는 난소절제술 수행 이후 OVX군에서 현저하게 떨어졌으며 ECH의 투여는 투여기간과 상관없이 모두 에스트로겐 농도에 영향을 미치지 못했다. 그러나 에스트로겐 수용체는 모든 그룹간의 차이가 없었으며 이는 난소절제술이 혈청 에스트로겐은 감소시키지만 에스트로겐 수용체의 발현에는 영향을 미치지 않음을 의미하며 ECH 역시 에스트로겐 수용체 발현에는 영향을 미치지 않음을 확인하였다. ECH의 6주간 단기 투여와 12주간 장기 투여에서 히알루론산, 엘라스틴 그리고 MMP에 대한 영향은 비슷한 양상을 보였다. ECH의 12주 장기 투여도 에스트로겐 저하에 의해 감소된 히알루론산을 증가시키지 못하였으나 히알루론산 합성 효소의 mRNA의 발현은 일부 증가시켰다. 또한 ECH의 투여 기간 동안 에스트로겐 저하에 의한 엘라스틴은 지속적으로 감소하였으나, ECH 투여로 감소된 엘라스틴 섬유와 엘라스틴 전구체가 유의하게 증가하는 것을 확인하였다. 에스트로겐 감소에 의해 증가된 MMP-1과 8의 mRNA 발현이 ECH의 12주간 장기 투여에 감소되는 것을 확인할 수 있었다. 그러나 콜라겐의 발현에 있어 6주와 12주 결과에 부분적으로 불일치하는 소견이 있다. 난소 절제술 6주 후에는 콜라겐 단백질의 발현은 감소하였으나, 콜라겐 전구체들의 mRNA 발현량의 차이가 없거나 오히려 증가하는 양상을 보였다. 그러나 난소 절제술 12주에는 콜라겐 단백질과 콜라겐 전구체들의 mRNA 발현이 모두 감소함을 확인하였다. 또한 ECH의 12주간 장기 투여시에 에스트로겐 결핍에 의해 감소된 콜라겐 단백질과 콜라겐 전구체들이 모두 증가하는 것을 확인하였다. 이는 난소절제술 후 급격한 에스트로겐 감소에 의해 콜라겐 전구체들의 변화가 있었으나, 에스트로겐 농도가 저하된 상태로 안정되면서 콜라겐 전구체 및 콜라겐 섬유들이 점진적으로 감소되고 ECH에 의해 증가됨으로 생각되어진다. 또한 산화스트레스의 확인 지표인 지질과산화물인 4-HNE를 성대고유층에서 확인하였으나 그룹간의 차이가 없었는데, 이는 지방이 거의 존재하지 않는 성대 고유층의 조직 구조 때문이라고 여겨지며, 산화-환원 전이에 영향을 미치는 효소인 SOD, CAT, 그리고 GPX가 난소절제술에 의해 감소하고 12주간의 ECH 투여에 유의하게 증가함을 확인하였다.
NOTESAuthors’ Contribution Conceptualization: Byung-Joo Lee, Ji-Min Kim. Data curation: Ji-Min Kim, Sung-Chan Shin. Formal analysis: Ji-Min Kim, Yong-Il Cheon. Methodology: Ji-Min Kim. Project administration: Byung-Joo Lee. Supervision: Byung-Joo Lee. Writing—original draft: Ji-Min Kim. Writing—review & editing; Sung-Chan Shin, Yong-Il Cheon. Approval of final manuscript: all authors. Fig. 1.Chemical structure of ECH. ECH (6-ethyl-2,3,5,7,8-pentahydroxy-1,4-naphthoquinone) is extracted from sea urchins (Saphechinus mirabilis). Its chemical structure contains 2,3,7-hydroxyl groups suitable for free radical scavenging. ECH, echinochrome A. 
Fig. 2.Estrogen receptors and serum estrogen levels. A: The level of serum estradiol decreased in the OVX, OVX group compared with the SHAM group. ECH treatment did not affect serum estradiol level. B: The immunohistochemistry staining analyses of representative estrogen receptors (ERs) in the lamina propria of vocal folds. The immune-positive area for ERβ was not change between groups. C: The quantitative polymerase chain reaction analyses of genes encoding representative Esr2a and Esr2b in the lamina propria of vocal folds. The expression of Esr2a and Esr2b was not change between groups. The scale bar in each panel is equal to 100 μm (40× magnification). One-way ANOVA test; ***p<0.001 vs. SHAM. SHAM, sham-operated rats; OVX, ovariectomized rats; ECH, echinochrome A; NS, not significant. 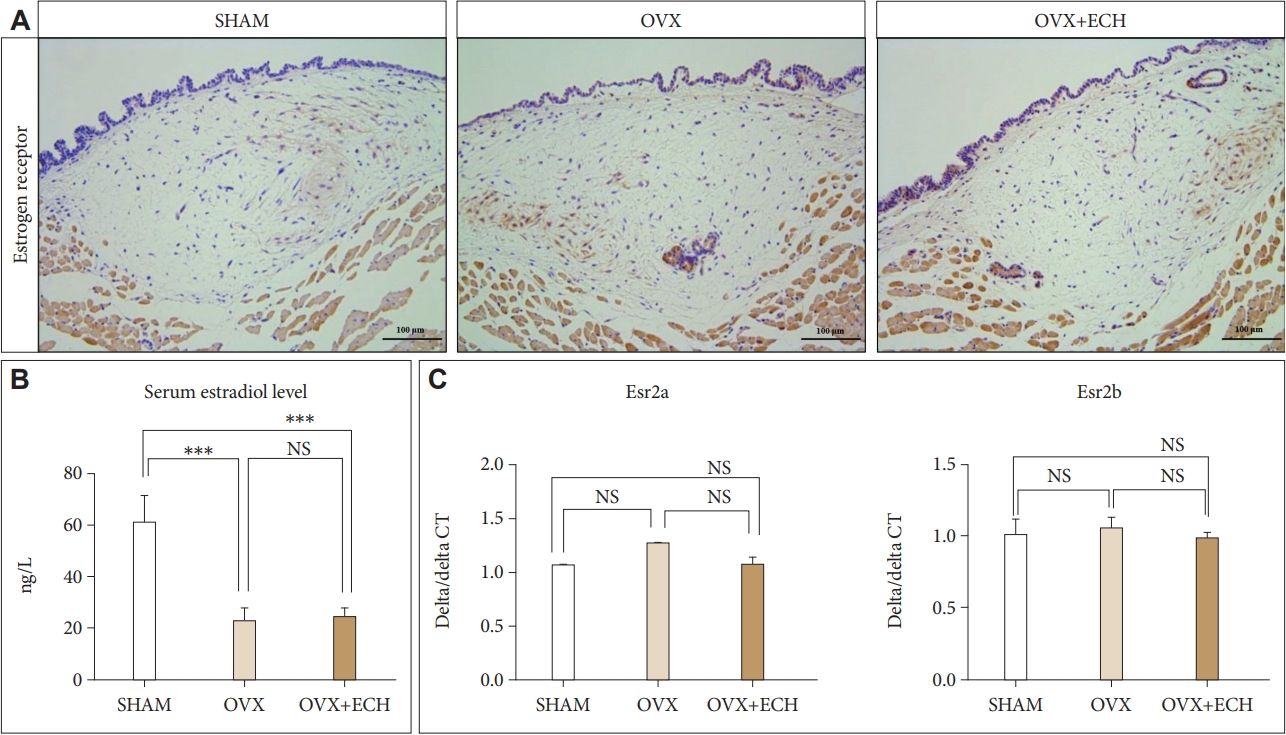
Fig. 3.Hyaluronic acid of vocal fold lamina propria. A: The alcian blue stained staining analyses of representative hyaluronic acid in the lamina propria of vocal folds. The concentration of hyaluronic acid was not change between groups (upper panel). The immunohistochemistry staining analyses of representative hyaluronic acid in the lamina propria of vocal folds (lower panel). The concentration of hyaluronic acid was not change between groups. B: The quantitative polymerase chain reaction analyses of genes encoding representative hyaluronic acid synthase (Has) 1, 2, and 3 in the lamina propria of vocal folds. The expression of Has1 was not change between groups. The expression of Has2 and Has3 were decreased significantly in the OVX group compare with the SHAM group, but ECH treatment had no effect. The scale bar in each panel is equal to 100 μm (40× magnification). One-way ANOVA test; *p<0.05; **p<0.01 vs. SHAM. SHAM, sham-operated rats; OVX, ovariectomized rats; ECH, echinochrome A; NS, not significant. 
Fig. 4.Collagens I and III of the vocal fold lamina propria. A: The immunohistochemistry staining analyses of representative collagen I (upper panel) and collagen III (lower panel) in the lamina propria of vocal folds. The immune-positive area for collagen I and III was decreased in the OVX group and increased in the OVX+ECH group. B: The quantitative polymerase chain reaction analyses of genes encoding representative procollagen Col1a1, Col1a2, and Col3a1 in the lamina propria of vocal folds. The expression of Col1a1, Col1a2, and Col3a1 were decreased significantly in the OVX group compare with the SHAM group, but significantly elevated in the OVX+ECH group. The scale bar in each panel is equal to 100 μm (40× magnification). One-way ANOVA test; *p<0.05; ***p<0.001 vs. SHAM; †p<0.05; ††p<0.01; †††p<0.001 vs. OVX. SHAM, sham-operated rats; OVX, ovariectomized rats; ECH, echinochrome A. 
Fig. 5.Elastin of vocal fold lamina propria. A: The Van Gieson stained staining analyses of representative elastin fibers in the lamina propria of vocal folds. The expression of elastin was not changed between groups. B: The quantitative polymerase chain reaction analyses of genes encoding representative Eln in the lamina propria of vocal folds. The expression of Eln decreased significantly in the OVX group compared with the SHAM group, but ECH treatment increased Eln level. The scale bar in each panel is equal to 100 μm (40× magnification). One-way ANOVA test; ***p<0.001 vs. SHAM; ††p<0.01 vs. OVX. SHAM, sham-operated rats; OVX, ovariectomized rats; ECH, echinochrome A; NS, not significant. 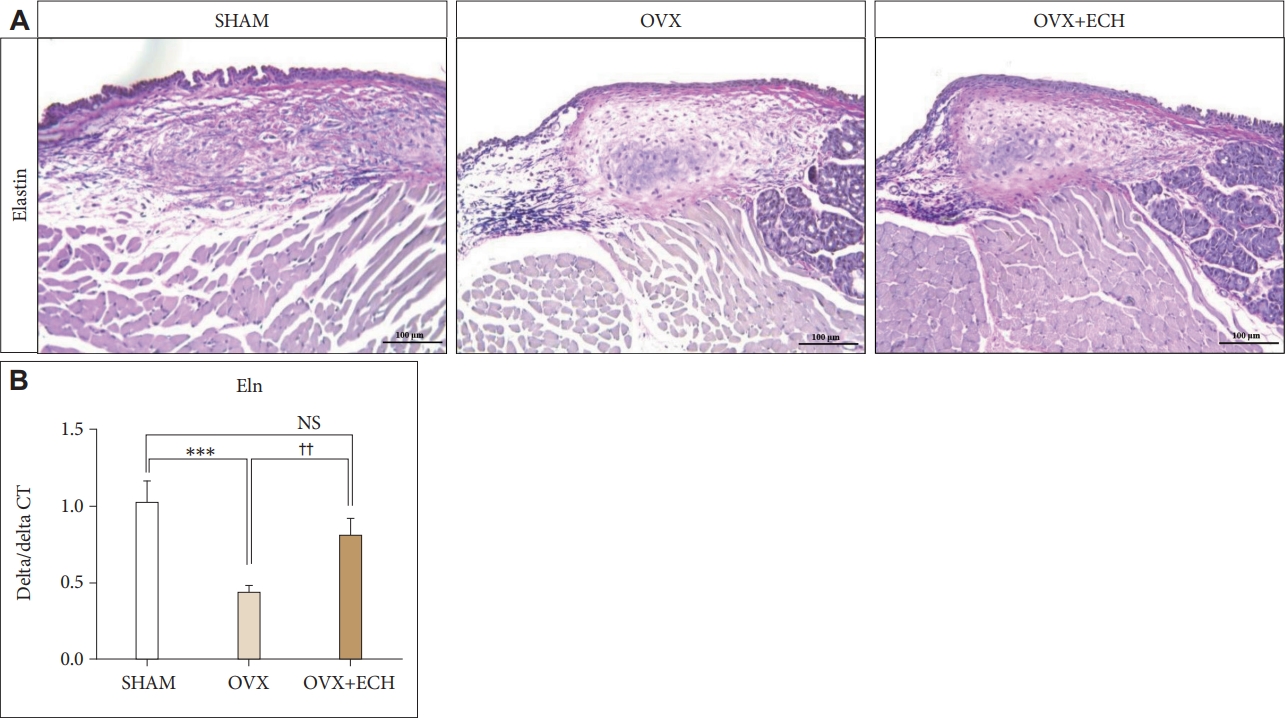
Fig. 6.MMP in vocal fold lamina propria. The quantitative polymerase chain reaction analyses of genes encoding representative MMP (MMP-1, 2, 8, and 9) in the lamina propria of vocal folds. The expression of the MMP MMP-1, 8, and 9 increased significantly in the OVX group compare with the SHAM group, but ECH treatment decreased MMP-1 and 8 levels. One-way ANOVA test; *p<0.05; ***p<0.001 vs. SHAM; †p<0.05 vs. OVX. MMP, matrix metalloproteinases; SHAM, sham-operated rats; OVX, ovariectomized rats; ECH, echinochrome A; NS, not significant. 
Fig. 7.4-HNE, SOD, CAT, and GPX of the vocal fold lamina propria. A: The immunohistochemistry staining analyses of representative 4-HNE (upper panel), SOD (middle panel), and CAT (lower panel) in the lamina propria of vocal folds. The immune-positive area for 4-HNE was not change between groups. The immune-positive area for SOD and CAT was decreased in the OVX group and increased in the OVX+ECH group. B: The quantitative polymerase chain reaction analyses of genes encoding representative SOD, CAT and GPX in the lamina propria of vocal folds. The expression of SOD, CAT, and GPX were decreased significantly in the OVX group compare with the SHAM group, but significantly elevated in the OVX+ECH group. The scale bar in each panel is equal to 100 μm (40× magnification). One-way ANOVA test; **p<0.01; ***p<0.001 vs. SHAM; †p<0.05; ††p<0.01 vs. OVX. SHAM, sham-operated rats; OVX, ovariectomized rats; ECH, echinochrome A; 4-HNE, 4-hydroxynonenal; SOD, superoxide dismutase; CAT, catalase; GPX, glutathione peroxidase. 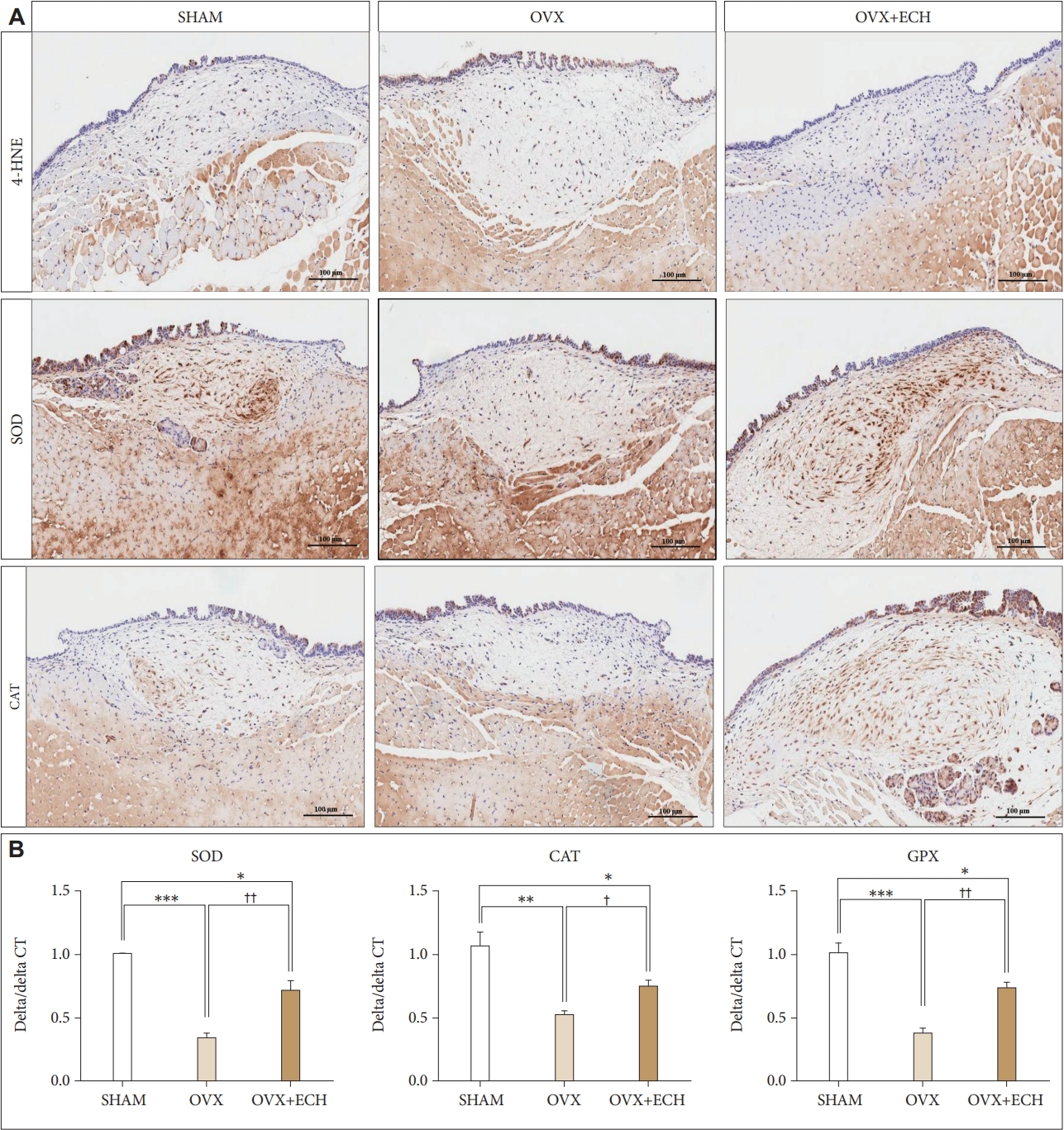
Table 1.Primers sequences REFERENCES1. Meurer EM, Wender MC, von Eye Corleta H, Capp E. Female suprasegmental speech parameters in reproductive age and postmenopause. Maturitas 2004;48(1):71-7.
2. Firat Y, Engin-Ustun Y, Kizilay A, Ustun Y, Akarcay M, Selimoglu E, et al. Effect of intranasal estrogen on vocal quality. J Voice 2009;23(6):716-20.
4. Mendes-Laureano J, Sá MF, Ferriani RA, Reis RM, Aguiar-Ricz LN, Valera FC, et al. Comparison of fundamental voice frequency between menopausal women and women at menacme. Maturitas 2006;55(2):195-9.
5. Hirano M. Morphological structure of the vocal cord as a vibrator and its variations. Folia Phoniatr (Basel) 1974;26(2):89-94.
6. Kim JM, Shin SC, Park GC, Lee JC, Jeon YK, Ahn SJ, et al. Effect of sex hormones on extracellular matrix of lamina propria in rat vocal fold. Laryngoscope 2020;130(3):732-40.
7. Caruso S, Roccasalva L, Sapienza G, Zappalá M, Nuciforo G, Biondi S. Laryngeal cytological aspects in women with surgically induced menopause who were treated with transdermal estrogen replacement therapy. Fertil Steril 2000;74(6):1073-9.
8. Abitbol J, Abitbol B. The voice and menopause: the twilight of the divas. Contracept Fertil Sex 1998;26(9):649-55.
9. Lindholm P, Vilkman E, Raudaskoski T, Suvanto-Luukkonen E, Kauppila A. The effect of postmenopause and postmenopausal HRT on measured voice values and vocal symptoms. Maturitas 1997;28(1):47-53.
10. Jeong SH, Kim HK, Song IS, Noh SJ, Marquez J, Ko KS, et al. Echinochrome a increases mitochondrial mass and function by modulating mitochondrial biogenesis regulatory genes. Mar Drugs 2014;12(8):4602-15.
11. Mizuta M, Hirano S, Hiwatashi N, Kobayashi T, Tateya I, Kanemaru S, et al. Effect of AST on age-associated changes of vocal folds in a rat model. Laryngoscope 2014;124(10):E411-7.
12. Ozawa S, Mukudai S, Kaneko M, Kinoshita S, Hashimoto K, Sugiyama Y, et al. Anti-inflammatory and antioxidant effects of Japanese herbal medicine kyoseihatekigan on vocal fold wound healing J Voice;In press 2021. https://doi.org/10.1016/j.jvoice.2021.10.003.
13. Kim JM, Kim JH, Shin SC, Park GC, Kim HS, Kim K, et al. The protective effect of echinochrome a on extracellular matrix of vocal folds in ovariectomized rats. Mar Drugs 2020;18(2):77.
14. Baker J. A report on alterations to the speaking and singing voices of four women following hormonal therapy with virilizing agents. J Voice 1999;13(4):496-507.
16. Mohamed AS, Soliman AM, Marie MAS. Mechanisms of echinochrome potency in modulating diabetic complications in liver. Life Sci 2016;151:41-9.
17. Lebedev AV, Ivanova MV, Krasnovid NI, Kol’tsova EA. [Acidity and interaction with superoxide anion radical of echinochrome and its structural analogs]. Vopr Med Khim 1999;45(2):123-30 Russian.
18. Kim JM, Shin SC, Cheon YI, Kim HS, Park GC, Kim HK, et al. Effect of echinochrome a on submandibular gland dysfunction in ovariectomized rats. Mar Drugs 2022;20(12):729.
|
|
|||||||||||||||||||||||||||||||||||||||